对于一些有毒有害的污染物质,当难以用生物法或物理方法处理时可利用它们在化学反应过程中能被氧化或还原的性质,改变污染物的形态,将它们变成无毒或微毒的新物质或者转化成容易与水分离的形态,从而达到处理的目的,这种方法称为氧化还原法。氧化还原法包括氧化法和还原法。
废水中的有机污染物(如色、嗅、味、COD)以及还原性无机离子(如 CN-、S2-、Fe2+、Mn2+ 等)都可通过氧化还原法消除其危害,而废水中的许多金属离子(如汞、铜、镉、银、金、铬、镍等)都可通过还原法去除。
废水处理中最常采用的氧化剂是空气、臭氧、氯气、次氯酸钠及漂白粉;常用的还原剂有硫酸亚铁、亚碗酸氢钠、硼氢化钠、水合肼及铁屑等。在电解氧化还原法中,电解槽的阳极可作氧
化剂,阴极可作还原剂。
按照污染物的净化原理,氧化还原处理方法包括药剂法、电化学法(电解)和光化学法三大类。在选择处理药剂和方法时,应当遵循些原则:1、处理效果好,反应产物无毒无害,不需进行二次处理;2、处理费用合理,所需药剂与材料易得;3、操作特性好,在常温和较宽的pH值范围内具有较快的反应速度;当提高反应温度和压力后,其处理效率和速度的提高能克服费用增加的不足;当符合变化后,通过调节操作参数,可维持稳定的处理效果;4、与前后处理工艺的目标一致,搭配方便。
与生物氧化法相比,化学氧化还原法需较高的运行费用。因此,目前化学氧化还原仅用于水处理、特种工业用水处理、有毒工业废水处理和以回用为目的的废水深度处理等有限的场合。
在化学反应中,氧化和还原是互相依存的。原子或离子失去电子成为氧化,接受电子称为还原。得到电子的物质称为氧化剂,失去电子的物质称为还原剂。各种氧化剂的氧化能力是不同的,可通过标准电位电极Eθ来表示氧化能力的强弱。在水中氧化能力最强的是氟。
许多种物质的标准电极电位值Eθ可在化学手册中查到。Eθ值越大,物质的氧化性越强;Eθ值越小,其还原性越强。例如,E(Cl2,Cl)=1.36V。其氧化态Cl2转化为CL-时,可以作为较强的氧化剂。相反E(S,S2-)=-0.48V,其还原态S2-转化为氧化态S时,可以作为较强的还原剂。两个电对的电位差愈大,氧化还原进行得越完全。
标准电极电位E是在标准状况下测定的,但在实际应用中,反应条件往往与标准状况不同,在实际的物质浓度、温度和pH值条件下,物质的氧化还原电位可用Nerst方程来计算:
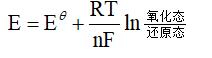
式中,E为一定浓度下的电极电势;Eθ为标准电极电势;R为常数,8.314J/(K·mol);T为温度,K;n为反应中电子转移的数目;[氧化态]为电极反应中氧化型一侧各物种浓度的乘积;[还原态]为电极反应中还原型一侧各物种浓度的乘积。
利用上式可估算处理程度,即求出氧化还原反应达平衡时各有关物质的残余浓度。例如:铜屑置换法处理含汞废水时有如下反应:
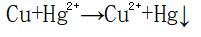
当反应在室温(25℃)达平衡时,相应原电池两级的电极电位相等:
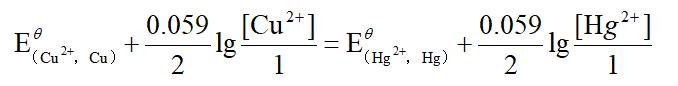
由标准电极电位表查得: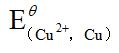 =0.34V,
=0.34V,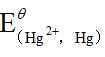 =0.86V,于是求得[Cu2+]/[Hg2+]=1017.5。可见,此反应进行得十分完全,平衡时溶液中残留Hg2+极微。
=0.86V,于是求得[Cu2+]/[Hg2+]=1017.5。可见,此反应进行得十分完全,平衡时溶液中残留Hg2+极微。
应用标准电极电位Eθ,还可判断氧化还原反应在热力学上的可能性和进行程度。
对于有机物的氧化还原过程,由于涉及共价键、电子的移动情形很复杂;凡是与强氧化剂作用而使有机物分解成简单的无机物如CO2、H2O等的反应,可判断为氧化反应。
有机物氧化为简单有机物是逐步完成的,这个过程称为有机物的降解。甲烷的降解大致经历下列步骤:
CH4→CH3OH→CH2O→HCOOH→CO2+H2O
甲烷 醇 醛 酸 无机物
复杂的有机化合物的降解历程和中间产物更为复杂。通常碳水化合物氧化的最终产物是CO2和H2O,含氮有机物的氧化产物除CO2和H2O,含氮有机物的氧化产物除CO2和H2O外,还会有硝酸类产物,含硫的还会有硫酸类产物,含磷的还会有磷酸类产物。各类有机物的可氧化性是不同的。经验表明,酚类、醛类、芳香胺类和某些有机硫化物(如硫醇、硫醚)等易于氧化;醇类、酸类、酯类、烷基取代的芳烃化合物(如“三苯”)、硝基取代的芳烃化合物(如硝基苯)、不饱和烃类、碳水化合物等在一定的条件下(强酸、强碱或催化剂)下可以氧化;而饱和烃类、卤代烃类、合成高分子聚合物等难以氧化。
由于多数氧化还原反应速率很慢,因此,在用氧化还原法处理废水时,影响水溶液中氧化还原反应速度的动力因素对实际处理能力有更为重要的意义,这些因素包括以下几个方面。
(1)反应物和还原剂的本性:影响很大,其影响程度通常由实验观察或经验来决定。
(2)反应物的浓度:一般,浓度升高,速度加快,其间定量关系与反应机理有关,可根据实验观察来确定。
(3)温度:一般讲,温度升高,速度加快,其间定量关系可由阿仑尼乌斯公示表示。
(4)催化剂及某些不纯物的存在:几年来异相催化剂(如活性炭、黏土、金属氧化物等)在水处理中的应用受到重视。
(5)溶液的pH值:影响很大,其影响途径有:1、H+或OH-直接参与氧化还原反应;2、H+或OH-为催化剂;3、溶液的pH值决定溶液中许多物质的存在状态及相对数量。